> サイトマップ
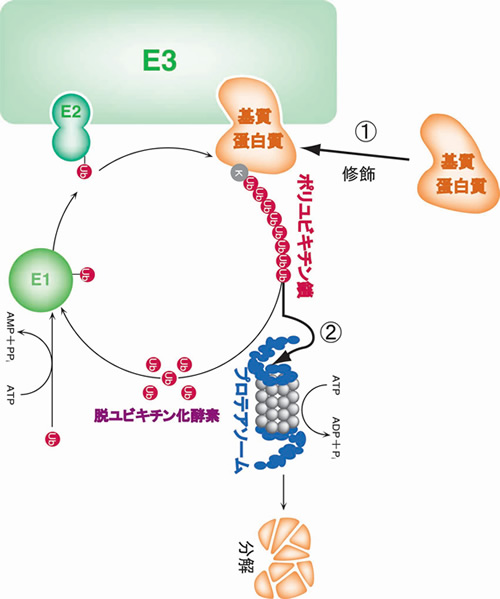
ユビキチン・プロテアソーム系はE1(活性化酵素)/E2(結合酵素)/E3(ユビキチンリガーゼ)の3種の酵素群の働きによりATP依存的に標的タンパク質にユビキチンを連続的に結合させてポリユビキチン鎖を形成し、そのポリユビキチン鎖がマークとなって標的タンパク質がプロテアソームにより選択的に識別されて分解へと至るシステムです(図)。現在ではユビキチン・プロテアソーム系は細胞周期・シグナル伝達・転写調節・代謝制御など数多くの生命現象を制御する重要なタンパク質分解系であることが報告されています。
ユビキチン・プロテアソーム系が生体制御において重要な役割を担い得るのは、生体内に数100種類存在すると考えられているE3:ユビキチンリガーゼが、時を得て選択的に標的タンパク質を識別出来ることによります。E3による選択的識別には標的タンパク質の翻訳後修飾が重要な役割を果たしていることが知られています。それゆえ、ユビキチン・プロテアソーム系の役割の理解にはユビキチン修飾の始動シグナルとして働く標的タンパク質の翻訳後修飾の同定と、その翻訳後修飾を選択的に識別するユビキチンリガーゼの機能の解析が重要です。
私たちは、これまでもユビキチン修飾系によって識別される標的タンパク質の翻訳後修飾に焦点を絞って研究を進めてきましたが、本特定研究ではそれをさらに発展させ、ユビキチン・プロテアソーム系が、選択的に識別した基質タンパク質を急速な分解に導くメカニズムの研究を推進します。具体的には、?ユビキチンリガーゼによる選択的な基質識別様式の研究をさらに推進するとともに、?ユビキチン化された標的タンパク質が速やかプロテアソームへの分解へと導くプロテアソームによるポリユビキチン鎖識別メカニズムに関する研究を進めます。
![]()